
Vědci z Ústavu organické chemie a biochemie AV ČR pomáhají pochopit, jak fungují léky a jak vyvinout jejich co možná nejúčinnější varianty. Konkrétně se zaměřili na nemoc, kterou způsobuje parazit Trichomonas vaginalis (bičenka poševní), zejména proto, že se v poslední době objevují kmeny, které jsou rezistentní vůči klasické léčbě. Skupina Dr. Evžena Bouři připravila v laboratoři enzym, který je pro organismus klíčový, protože díky němu dokáže buňka zpracovávat staré bílkoviny a vytvářet nové. Získala tak údaje nezbytné pro vývoj účinných léků. Spolupracovala přitom s kolegy z Kalifornské univerzity v San Diegu. Článek otiskl vědecký časopis Nature Communications.
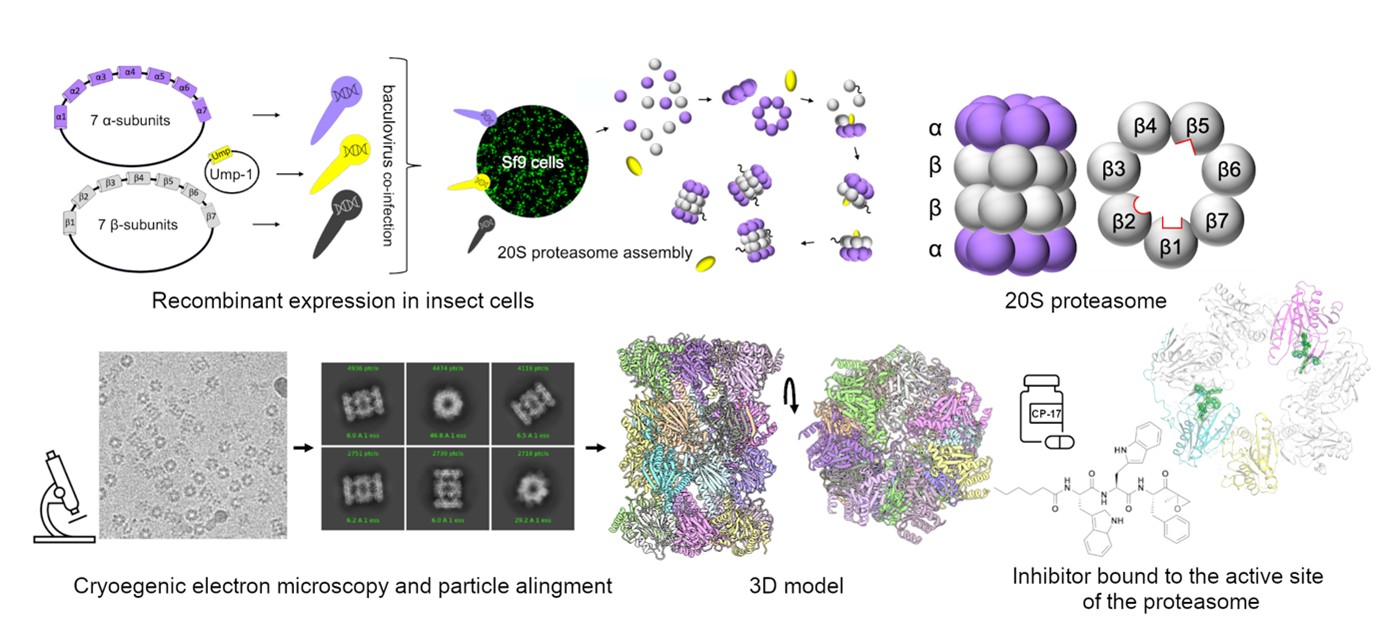
Vědci zkoumali enzym proteazom, který v buňkách funguje jako přístroj na recyklaci starých bílkovin. Je to enzym válcovitého tvaru tvořený sedmi podjednotkami uspořádanými do čtyř kruhů nad sebou. Do něj plynou staré proteiny, které proteazom „štípá“ na malé kousky, a ty pak buňka používá do nových bílkovin. Pokud nefunguje správně, v buňce se hromadí staré bílkoviny a ona umírá. Blokování funkce proteazomu se proto využívá například u některých druhů zhoubných nádorů k ničení rakovinných buněk.
Stejným způsobem by mělo být možné léčit také značně rozšířenou, sexuálně přenosnou infekci trichomoniázu, která zvyšuje riziko nákazy virem HIV. Cílem je najít látky, které zablokují funkci proteazomu v buňkách parazita Trichomonas vaginalis. Dosud se nedařilo izolovat proteazom přímo z tohoto organismu, a proto vědci z ÚOCHB připravili proteazom umělý, shodný s přirozeným, a to v hmyzích buňkách. Tato část jejich výzkumu byla nejsložitější a na jejím zvládnutí závisel úspěch celého projektu. Díky tomu dokázali jako první popsat dosud neznámou strukturu proteazomu, což je naprosto klíčové pro vývoj efektivnější léčby.
„Proteazom vypadá u každého živočicha stejně, ovšem detaily tohoto ‚válečku‘ se liší. A právě tyhle detaily je nutné znát, protože pak můžeme vytvořit látku, která je toxická pro parazita, aniž by škodila lidskému organismu. Pro vývoj léků je tahle okolnost naprosto nezbytná. Největší úspěch je, že jsme dokázali připravit rekombinantní, tedy umělý proteazom, který nám potřebné informace může poskytnout,“ vysvětluje Evžen Bouřa.
Vědci využili pokročilou elektronovou mikroskopii a díky vysokému rozlišení mohli sledovat téměř každý atom. Vyzkoušeli, jak na proteazom zabírají dvě potenciálně léčivé látky. Viděli, jak se vážou na aktivní místo proteazomu a za jakých okolností proteazom přestává fungovat, což je pro buňky parazita smrtelné.
Výzkum vznikl v rámci projektu Národní institut virologie a bakteriologie (LX22NPO5103, EXCELES), který je financován z prostředků Evropské unie - NextGenerationEU.
Původní článek
- Silhan, J.; Fajtova, P.; Bartosova, J.; Hurysz, B. M.; Almaliti, J.; Miyamoto, Y.; Eckmann, L.; Gerwick, W. H.; O’Donoghue, A. J.; Boura, E. Structural elucidation of recombinant Trichomonas vaginalis 20S proteasome bound to covalent inhibitors. Nat. Commun. 2024, 15, 8621. https://doi.org/10.1038/s41467-024-53022-w






